En 2012, la microbiologiste française Emmanuelle Charpentier, et la biochimiste américaine Jennifer Doudna, de l’Université de Californie à Berkeley, ont révolutionné les domaines de la biotechnologie et de la génétique en développant le système CRISPR-Cas9, communément surnommé les “ciseaux génétiques”, une méthode d’édition du génome permettant de modifier avec précision des séquences d’ADN. [1].
Inspiré par les mécanismes de défense des bactéries contre les virus, ce système utilise l’endonucléase Cas9 et un ARN guide pour cibler et couper l’ADN à des emplacements spécifiques, ouvrant ainsi la voie à des applications d’ingénierie génétique dans des domaines allant de l’agriculture à la médecine.
Leur travail a été récompensé par le Prix Nobel de Chimie en 2020, soulignant l’importance de leur découverte [2].
Onze ans plus tard, la toute première thérapie génique basée sur CRISPR-Cas9 a été approuvée, signalant le début d’une véritable révolution thérapeutique [3]. Cette thérapie “exagamglogene autotemcel”, à laquelle a été donné le nom de marque CASGEVY, a été développée en collaboration par Vertex Pharmaceuticals (Boston, USA) et CRISPR Therapeutics (suisso-américain, co-fondé par Emmanuelle Charpentier en 2013). Elle est conçue pour traiter sous certaines conditions la drépanocytose et la bêta-thalassémie transfusion-dépendante, deux maladies génétiques causées par des anomalies dans les gènes de l’hémoglobine.
L’autorisation de CASGEVY a d’abord été accordée par la Medicines and Healthcare products Regulatory Agency, les autorités sanitaires du Royaume-Uni, le 16 novembre 2023 [4]. Par la suite, la Food and Drug Administration (FDA)* des États-Unis a approuvé ce traitement pour la drépanocytose le 8 décembre 2023 [5], puis pour la bêta-thalassémie transfusion-dépendante le 16 janvier 2024 [6].
Quelles sont les conditions d’utilisation de CASGEVY ?
CASGEVY a été autorisé pour traiter les patients d’au moins 12 ans atteints de bêta-thalassémie et de drépanocytose. Pour la bêta-thalassémie, elle est destinée aux patients devant subir des transfusions sanguines régulières en raison d’une production insuffisante d’hémoglobine, entraînant un faible taux de globules rouges [7]. Pour la drépanocytose, CASGEVY cible les patients souffrant de crises douloureuses récurrentes causées par des globules rouges anormaux qui peuvent obstruer les vaisseaux sanguins et réduire l’espérance de vie [8]. Jusqu’à cette avancée thérapeutique, la seule option curative pour ces maladies consistait en une greffe de cellules souches hématopoïétiques (cellules à l’origine de toutes les cellules sanguines du corps) lorsqu’un donneur compatible est trouvé, ce qui est rare.
Comment fonctionne CASGEVY ? La première étape consiste à prélever les cellules souches sanguines du patient. Elles seront ensuite modifiées en laboratoire par CRISPR-Cas9 afin qu’elles produisent davantage d’hémoglobine fœtale. Les cellules ainsi modifiées sont restituées au patient par greffe de moelle osseuse, suite à une chimiothérapie permettant d’éliminer certaines cellules souches pour faire de la place aux nouvelles cellules sanguines. Après la transplantation, les cellules modifiées commencent à produire de nouveaux globules rouges, permettant ainsi de compenser l’hémoglobine défectueuse des patients [7] [8].
Qu’en est-il de la législation en Europe ?
En Europe, CASGEVY a été intégré au programme PRIORITY MEdicines (PRIME) de l’Agence européenne des médicaments (EMA) en 2020 pour la drépanocytose et en 2021 pour la bêta-thalassémie [9]. Ce programme offre un soutien scientifique et réglementaire précoce et renforcé aux médicaments répondant à des besoins médicaux non satisfaits. Le 15 décembre 2023, le Comité des médicaments à usage humain de l’EMA a émis un avis positif pour l’approbation conditionnelle de CASGEVY. Cela signifie que les avantages du traitement l’emportent sur les risques, tout en nécessitant des preuves supplémentaires post-autorisation [9].
La Commission européenne a ensuite accordé une autorisation de mise sur le marché en février 2024, sous les mêmes conditions qu’aux États-Unis, faisant de CASGEVY la première thérapie génique approuvée dans l’Union européenne [10]. Pour confirmer son efficacité et sa sécurité, l’entreprise devra fournir les résultats finaux des essais cliniques d’ici août 2026, ainsi que les résultats d’études de suivi à long terme sur 15 ans.
Perspectives de la thérapie génique CRISPR et impact sur la politique scientifique :
Une étude récente menée par l’Innovative Genomics Institute, fondé par Jennifer Doudna, illustre les progrès des essais cliniques CRISPR dans le traitement de diverses maladies.
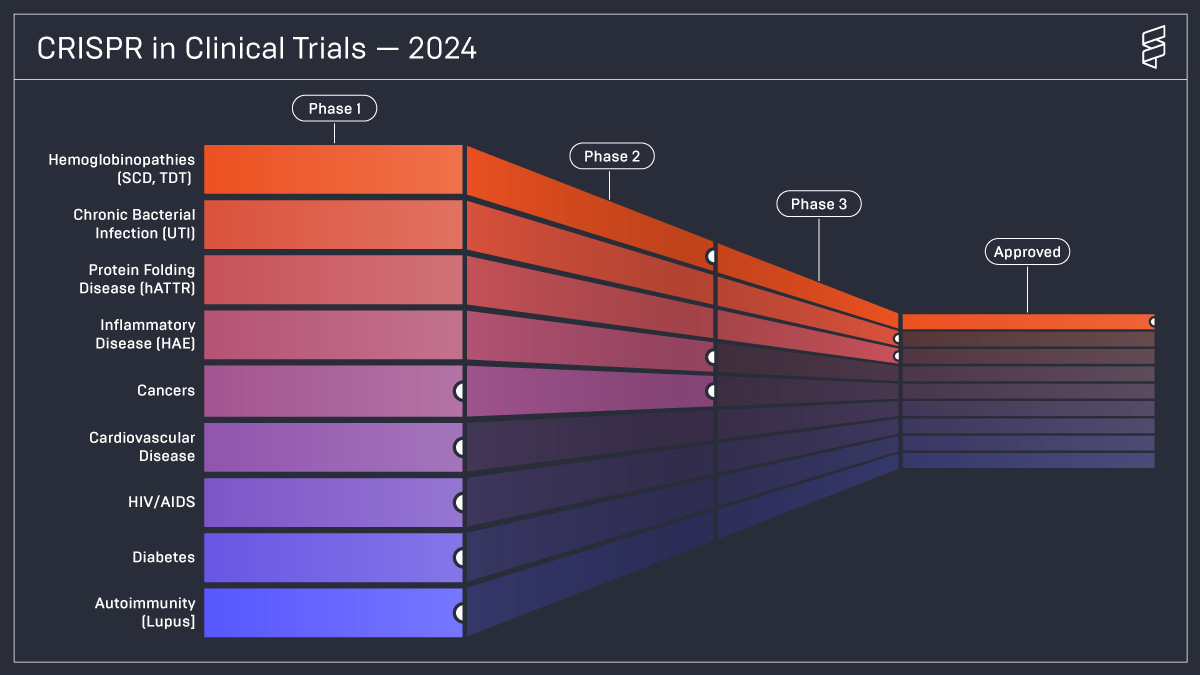
Afin d’accélérer les autorisations de mise sur le marché des certains produits pharmaceutiques, le Congrès américain a adopté en 2022 une loi demandant à la FDA de créer un statut spécifique pour les médicaments issus de “plateforme technologique” (e.g. structure moléculaire, mécanisme d’action, méthode d’administration, vecteur…). En mai 2024, le Center for Drug Evaluation and Research et le Center for Biologics Evaluation and Research de la FDA ont publié les premières lignes directrices de ce statut spécifique [11].
Très récemment, la FDA a donné son feu vert pour le premier essai clinique mondial de “prime editing”, une version améliorée de CRISPR-cas9 qui permet de réécrire les gènes défectueux sans casser l’ADN [12].
Comment cette révolution thérapeutique se répercute sur l’écosystème scientifique aux États-Unis et en France ?
Aux États-Unis :
Afin d’accélérer les recherches et la mise sur le marché de traitements thérapeutiques, le fond commun du National Institute of Health (NIH) a mis en place en 2018 le Common Fund’s Somatic Cell Genome Editing. Pour la première phase de ce programme, d’une durée de cinq ans, le NIH avait accordé 21 subventions totalisant environ 86 millions de dollars pour permettre de développer des outils pour une édition génétique sûre et efficace chez l’humain [13]. En 2023, le programme est passé à sa deuxième phase, visant à accélérer le passage des thérapies géniques aux essais cliniques. Le NIH a alloué plus de 140 millions de dollars à divers projets de recherche, intensifiant ainsi ses efforts pour convertir les découvertes scientifiques en traitements cliniques [14].
Les programmes fédéraux de subvention Small Business Innovation Research (SBIR) et Small Business Technology Transfer (STTR), administrés par le NIH, ont enregistré une augmentation de 70% des subventions pour les entreprises utilisant CRISPR entre 2022 et 2023, reflétant l’intérêt croissant et le soutien renforcé pour les innovations en thérapie génique basées sur cet outil [15].
En France :
Depuis l’annonce du passage de CASGEVY dans le programme PRIME en 2020, de nombreuses startups ont utilisé ce momentum pour réaliser d’importantes levées de fonds et accélérer leurs projets en lien avec la thérapie génique.
Par exemple, la startup Astraveus qui développe une plateforme permettant de réduire le coût de la thérapie génique a levé lors de son tour d’amorçage en juin 2023 16.5 millions d’euros, mené en partie par le fond Large Venture de Bpifrance, ensuite labellisé FrenchTech 2030. En octobre 2023 elle reçoit une subvention de 10.4 millions d’euros du gouvernement français dans le cadre du plan d’investissement France 2030 [16].
Le 28 mai 2024, la Commission européenne a approuvé le premier Important Project of Common European Interest (IPCEI) visant à soutenir la recherche, l’innovation et les processus de production de produits pharmaceutiques, notamment de thérapie génique. La France, avec la Belgique, la Hongrie, l’Italie, la Slovaquie et l’Espagne ont notifié ce projet nommé IPCEI Med4cure et fourniront jusqu’à 1 milliard d’euros de financement public, ce qui devrait permettre de débloquer 5.9 milliards d’euros d’investissements privés supplémentaires [17].
Ces exemples illustrent que la France est en pleine effervescence dans le secteur de la thérapie génique, avec un écosystème dynamique et des investissements significatifs qui soutiennent la recherche et l’innovation.
En conclusion, bien que CASGEVY ouvre la porte à de futures avancées majeures dans le traitement des maladies génétiques, son coût de 2,2 millions de dollars et le manque d’infrastructures en place pour administrer le traitement soulève des questions quant au nombre de personnes qui en bénéficieront (i.e. : seulement 18 Authorized Treatment Centers aux États-Unis [7] [8]. Par ailleurs, les débats sur le remboursement de cette thérapie par les assurances et les programmes de santé publique sont en cours. En janvier 2024, le Centers for Medicare and Medicaid Services du gouvernement fédéral a introduit le Cell and Gene Therapy Access Model, qui vise à faciliter les négociations inter-états et à lever les obstacles liés à l’accès aux nouvelles thérapies géniques [18].
*La FDA est une agence du ministère américain de la santé et des services sociaux (U.S. Department of Health and Human Services) pour la protection de la santé publique en garantissant l’innocuité, l’efficacité et la sécurité des médicaments, des vaccins et des dispositifs médicaux. L’agence est également responsable de la sûreté et de la sécurité de l’approvisionnement alimentaire des États-Unis.
Références
[2] The Nobel Prize in Chemistry 2020
[4] UK medicines regulator approves world-first gene-editing treatment for blood disorders
[5] FDA Approves First Gene Therapies to Treat Patients with Sickle Cell Disease
[6] FDA clears first CRISPR treatment for a second disease, beta thalassemia
[7] CASGEVY for the treatment of sickle cell disease
[8]CASGEVY for the treatment of transfusion-dependent beta thalassemia
[9] EMA has recommended approval of the first medicine using CRISPR/Cas9
[10] EU autorisation for CASGEVY
[11] Platform Technology Designation Program
[12] The FDA Has Cleared the First Clinical Trial Application for a Prime Editor
[13] NIH Awards $86 Million to Improve Genome Editing Techniques
[14] NIH awards $140 million to help accelerate genome editing approaches from the lab to the clinic
[15] SBIR and STTR awards for CRISPR technology
[16] Astraveus news
[18] Cell and Gene Therapy Access Model
Pour en savoir plus :
• Sur l’édition génomique par CRISPR-cas9
• Sur le Common Fund’s Somatic Cell Genome Editing
Rédactrice :
Célestine Belloeil, Chargée de mission scientifique au Consulat Général de France à Los Angeles, [email protected]